糖基化是蛋白质最常见的翻译后修饰之一,其糖链结构具有高度多样性、复杂性与动态性。据估计,哺乳动物约80%的蛋白质可发生糖基化修饰,但当前的鉴定深度远未达到预测水平。如何高效、准确地解析体内糖蛋白位点的特异性糖链,是深入理解健康与疾病分子机制的关键。由于糖链结构复杂、异质性强以及糖肽丰度低等原因,基于质谱的N-糖蛋白质组学长期面临鉴定效率低、数据准确性不足等挑战。
近日,我院分子酶学研究所方盼教授团队和复旦大学生物医学研究院团队合作在Nature Communications在线发表题为“Ultradeep N-glycoproteome atlas of mouse reveals spatiotemporal signatures of brain aging and neurodegenerative diseases”的研究成果,首次构建了迄今规模最大的小鼠多器官N-糖蛋白组数据库。

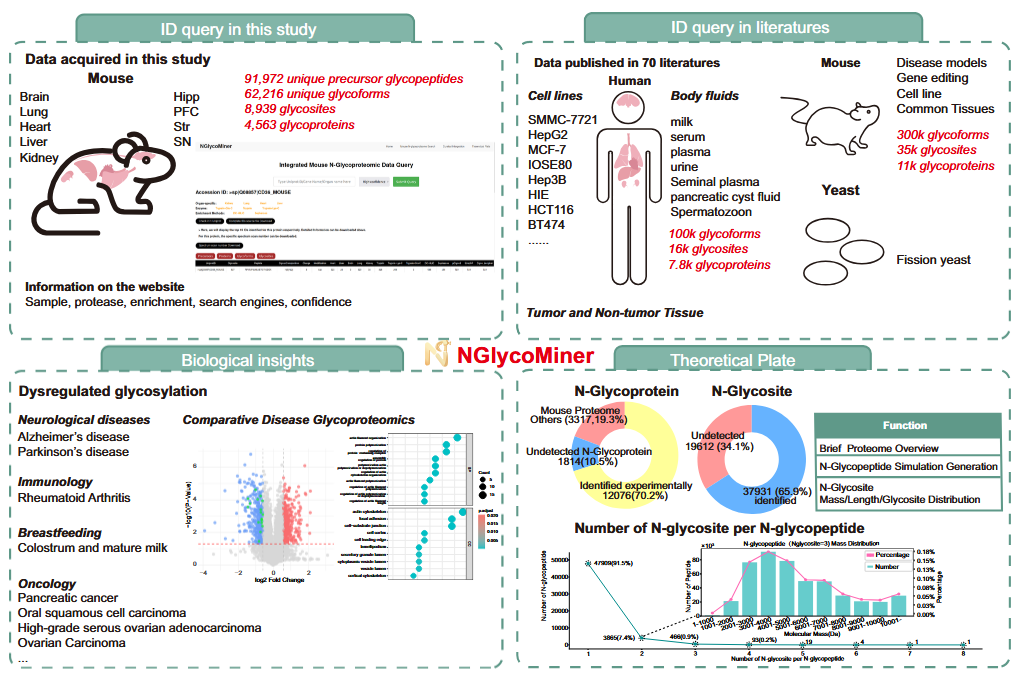
研究团队从小鼠心、肝、脑、肺、肾五大组织中共鉴定出91,972个糖肽,62,216个糖型,8,939个糖基化位点和4,563个糖蛋白。该数据集为研究N-糖蛋白质组的时空异质性提供了宝贵资源。研究者利用超过680万张含糖质谱图,并通过四款主流糖肽搜索软件进行交叉比对与整合。在“多软件一致结果可信度更高”的假设下,筛选出16万张高置信度谱图和40万张中等置信度谱图。这些高质量谱图不仅丰富了糖肽标准库,也为AI模型训练提供了优质数据。研究进一步聚焦小鼠海马、前额叶皮层、黑质和纹状体四个关键脑区,开展空间和时间维度的糖蛋白组学研究,系统揭示糖基化在衰老及阿尔茨海默病与帕金森病等神经退行性疾病中的变化规律,发现糖基化修饰呈现显著的时空特异性,在疾病进程中发挥重要调控作用。
为便于研究者获取和利用这些数据,团队搭建了在线数据库N-GlycoMiner(www.NGlycoMiner.com),支持位点特异性糖链和组织特异性糖蛋白的查询。目前平台整合了来自本研究及既往文献的12,078个小鼠N-糖蛋白,覆盖了约87%的理论小鼠N-糖蛋白组,为糖基化相关研究提供了系统化、高精度的数据支持。
原文链接:https://www.nature.com/articles/s41467-025-60437-6#Sec10

